В США адвокаты, подавшие коллективный иск против Philips в связи с отозванными ею дыхательными аппаратами, приборами для искусственной вентиляции легких и аппаратами для сна при апноэ, в понедельник направили дополнительные документы. В них есть новые свидетельства того, что производитель слишком долго не реагировал на сообщения о проблемах с оборудованием и только в прошлом году принял решение о его отзыве с рынка.
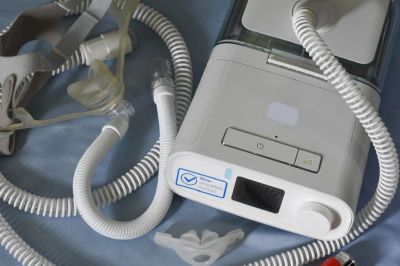
В США подан коллективный иск против Philips, в котором говорится, что из-за проблем с дыхательными аппаратами этого бренда у истцов был диагностирован широкий спектр заболеваний, включая рак, хроническую обструктивную болезнь легких и заболевание почек. Адвокаты пациентов считают, что компания знала о проблемах с оборудованием еще в 2015 году, но не реагировала на них вплоть до прошлого года, сообщает MedTechDive.
В июне 2021 года Philips инициировала отзыв миллионов дыхательных аппаратов, приборов для искусственной вентиляции легких и аппаратов для сна при апноэ из-за риска для здоровья, связанного с пеноматериалом, который используется в этих устройствах. Полиэфирная полиуретановая пена, или PE-PUR, может распадаться на частицы, которые пациенты могут вдыхать или проглатывать, что в состоянии вызвать головную боль, головокружение, раздражение, тошноту и канцерогенные эффекты, информировала компания.
Управление по контролю за качеством пищевых продуктов и медикаментов США (FDA) классифицировало отзыв дыхательных аппаратов и аппаратов ИВЛ Philips как один из наиболее серьезных случаев, отметив, что было зарегистрировано более 1,2 тыс. жалоб и около 100 травм. С тех пор в стране было отозвано более чем 5,5 млн устройств, а FDA зафиксировало более 69 тыс. жалоб. Миллионы пациентов все еще ждут замены устройств, поскольку Philips столкнулась со сбоями в цепочке поставок и неожиданно большим количеством запросов на замену.
Отзыв оборудования был инициирован лишь в США. В России устройства не отзывали, вместо этого внедряется программа корректирующих мероприятий. Она включает в себя информирование пользователей о потенциальных последствиях для здоровья пациентов и клинического использования, связанных с выявленной проблемой, а также рекомендации по ее устранению.
 Химки ИНФО – ещё ближе к городу Новости Химок, важные события и происшествия, инфопортал Химки ИНФО – самые свежие и популярные новости.
Химки ИНФО – ещё ближе к городу Новости Химок, важные события и происшествия, инфопортал Химки ИНФО – самые свежие и популярные новости.